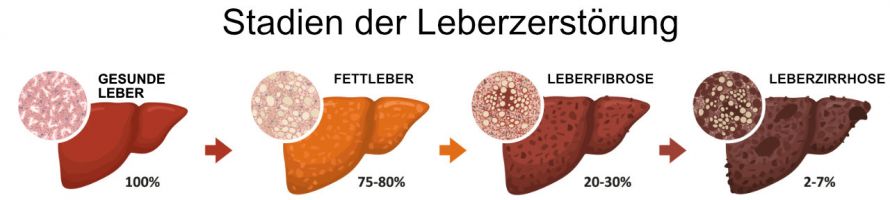
Bei einer Leberfibrose wird das Gewebe der Leber nach und nach umgebaut.
Zu Beginn einer Leberfibrose wandeln sich Fettzellen (Lipozyten) und Leber-Sternzellen (Ito-Zellen) in kollagenbildende Zellen um. Die Menge an produziertem Kollagen steigt infolgedessen an, während gleichzeitig immer weniger Kollagen abgebaut wird. Dadurch lagern sich vermehrt kollagene Fasern im Lebergewebe und den funktionellen Einheiten der Leber, den Lebersinusoiden, ab.
Kollagen als Gerüstsubstanz des Bindegewebes wird vermehrt in die inneren Leberstrukturen eingelagert. So können im Verlauf der Leberfibrose zunehmend Störungen der Leberfunktion auftreten. Die Leber arbeitet immer weiter eingeschränkt, bis zum vollständigen Funktionsverlust.
Die Leberfibrose ist an sich keine typische Folge einer einzelnen Leberschädigung oder einer Infektion. Stattdessen kann eine Leberfibrose auf dem Boden verschiedener Vorerkrankungen entstehen. Dazu gehören unter anderem:
Darüber hinaus kann sich eine Leberfibrose in einem weit fortgeschrittenen Stadium ebenso zirrhotisch umbilden. Das führt zu einem Funktionsverlust der Leber infolge einer Leberzirrhose.
Bei der Leberfibrose ist die Funktion der Leber bereits schwer geschädigt © nmfotograf | AdobeStock
In der Mehrzahl der Fälle bleibt die Leberfibrose symptomlos. Die Betroffenen bemerken daher zunächst nichts von der Erkrankung. Spürbar wird der bindegewebige Umbau der Leber daher erst im Stadium einer Leberzirrhose. Dann kann es zum Beispiel zur Gelbsucht (Ikterus) oder zu einem unangenehmen Hautjucken kommen.
Einige Menschen klagen zudem über unspezifische Begleitsymptome, die oft gemeinsam mit einer Leberfibrose auftreten können. Dazu zählen beispielsweise:
Mithilfe der Sonographie (Ultraschalluntersuchung) können Ärzte z. B. veränderte Strukturen in der Leber sichtbar machen.
Auch die Blutuntersuchung ist ein bewährtes Mittel auf der Suche nach Erkrankungen der Leber. Betroffene haben dann meist erhöhte Kollagen-IV-Werte sowie mehr Leberenzyme (Aspartat-Aminotransferase, AST und Alanin-Aminotransferase, ALT) im Blut.
Die Leberfibrose selbst ist nicht therapier- oder umkehrbar. Das heißt: Einmal geschädigtes Lebergewebe bleibt geschädigt. Daher richtet sich der Verlauf der Erkrankung
- in erster Linie nach dem Anfangsstadium bei Diagnose und
- nach dem Erfolg einer Therapie der zugrundeliegenden Ursache für den bindegewebigen Umbau.
Im günstigsten Fall erfolgt eine frühe Diagnose der Leberfibrose. Dann kann die Behandlung eine Verschlechterung frühzeitig stoppen.
Ohne Therapie der Ursache wird die Leberfibrose im Endstadium schließlich in eine Leberzirrhose übergehen.
Die Therapie der Leberfibrose zielt stets auf die Grunderkrankung ab. So lässt sich beispielsweise eine Virushepatitis medikamentös behandeln, wodurch auch die Leberfibrose gestoppt werden kann. Eine medikamentöse Behandlung der Leberfibrose selbst ist hingegen heutzutage (noch) nicht möglich.
Bei einer fortgeschrittenen Leberfibrose wird meist nur symptomatisch behandelt. Eine Heilung ist zwar nicht möglich, die Patienten können aber ein Maß an Lebensqualität erhalten. Häufige Maßnahmen sind dann z. B.
- eine Ernährungsumstellung,
- mehr Bewegung und
- kleinere operative Eingriffe zur Verlegung der Gallengänge.
Eine Lebertransplantation ist in besonders schweren und weit fortgeschrittenen Fällen notwendig.
Zur Vorbeugung einer Leberfibrose sollten Sie in erster Linie auf Alkohol verzichten.
Achten Sie auch auf in größeren Mengen leberschädigende Medikamente. Eines der bekanntesten ist Paracetamol.
Ferner können Normalgewicht sowie Impfungen gegen Hepatitis A und B bestimmte Ursachen für eine Leberfibrose verhindern.
Die Leber ist das wichtigste Stoffwechselorgan des menschlichen Körpers. Ihre Diagnose und Behandlung gehört in die Hände von Fachärzten für Innere Medizin mit Spezialisierung in der Hepatologie. Sie arbeiten manchmal in speziellen Leber-Therapiezentren. Diese verfügen über solide Kenntnisse und Fallzahlen, um eine sehr gute Versorgung der Betroffenen zu gewährleisten.
Je nach zugrundeliegender Grunderkrankung kann es zusätzlich notwendig sein, weitere Fachärzte heranzuziehen, etwa aus
Sollte eine Lebertransplantation erforderlich sein, sollten Spezialisten für Transplantationsmedizin an der Behandlung der Leberfibrose beteiligt sein.












